Suo/a figlio/a convive con una rara malattia chiamata iperossaluria primaria (primary hyperoxaluria, PH)?
Le potrebbe interessare il programma di sperimentazione clinica PHYOX™, una serie di studi di ricerca che valutano un nuovo farmaco sperimentale chiamato nedosiran, in precedenza DCR-PHXC, per il trattamento dei pazienti affetti da PH.
Per ulteriori informazioni sulla sperimentazione, visiti clinicaltrials.gov e inserisca il numero identificativo NCT 05001269, oppure acceda al seguente link: https://clinicaltrials.gov/ct2/show/NCT05001269.
I residenti nell’UE possono visitare il sito EudraCT e inserire il numero identificativo 2021-001083-16.

Mio/a figlio/a è idoneo/a?
Per partecipare alla sperimentazione clinica PHYOX8, devono essere soddisfatti i seguenti criteri:
- da neonato fino a 11 anni;
- durante il periodo dello studio non si deve essere sottoposti a trattamento di dialisi o necessitare di dialisi;
- diagnosi documentata di PH1 o PH2;
- nessuna anamnesi o attuale necessità di trapianto d’organo.

Se Suo/a figlio/a è affetto/a da PH1 o PH2 e desidera saperne di più sulle sperimentazioni cliniche PHYOX™, compili il modulo sottostante.
Un rappresentante dello studio La contatterà e risponderà alle Sue domande. Le Sue informazioni saranno utilizzate solo per lo scopo di questo studio, se non altrimenti autorizzato.
“*“ Indica i campi obbligatori
Saranno applicati ulteriori requisiti che saranno discussi con Lei dal personale dello studio. L’idoneità sarà determinata da un medico dello studio.
Che cosa aspettarsi
Circa 20 partecipanti saranno arruolati nello studio per ricevere dosi mensili di nedosiran per un periodo di 6 mesi.
La seguente figura illustra alcune delle attività che un/a partecipante può aspettarsi a ogni visita dello studio:
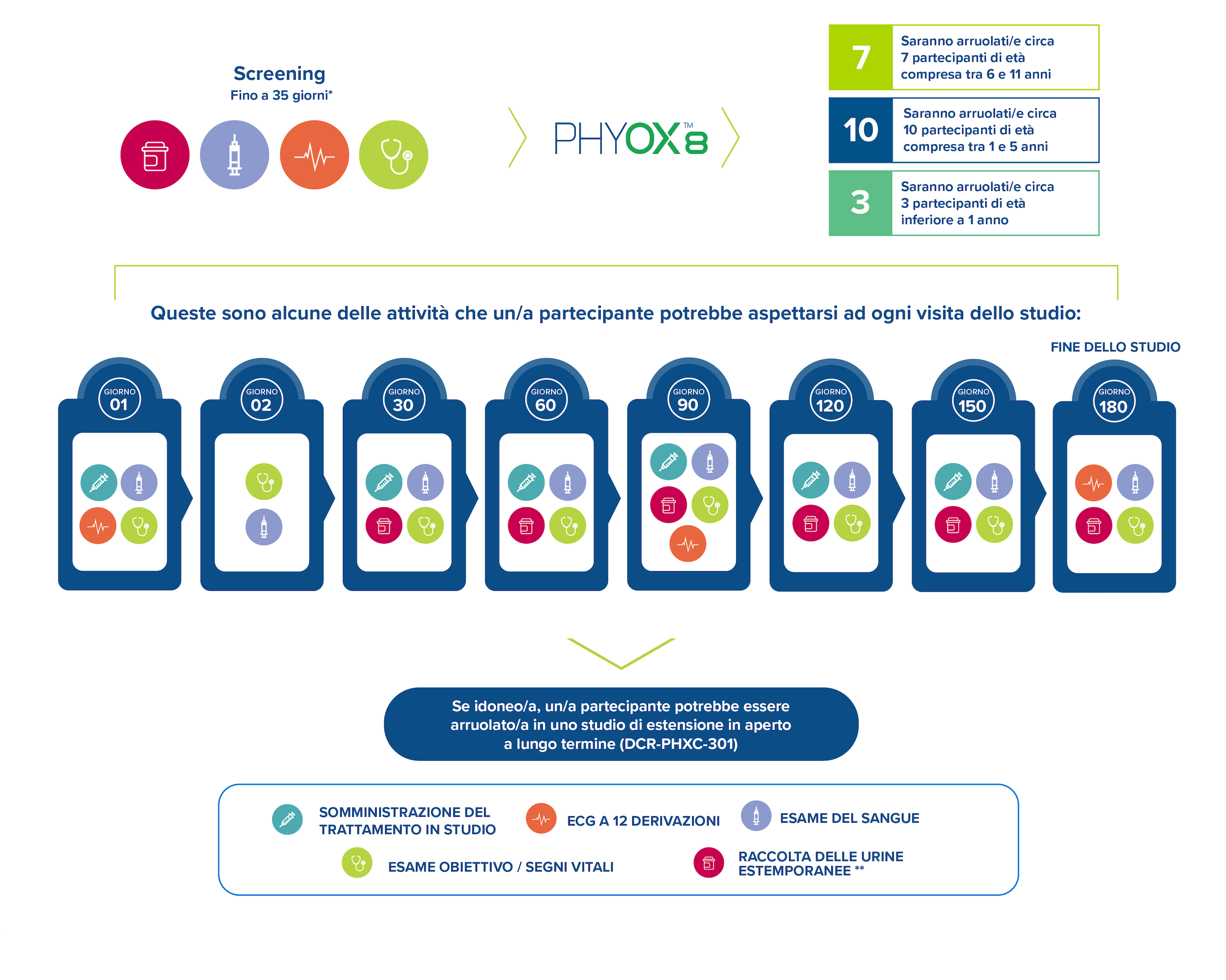
Inoltre, un/a partecipante può aspettarsi di essere sottoposto/a a un’ecografia renale ed ecocardiogramma allo screening e al Giorno 180 della sperimentazione. Dopo il completamento dello studio PHYOX8, i/le partecipanti potrebbero essere idonei/e per il follow-up a lungo termine nello studio PHYOX3.
Informazioni sull’iperossaluria primaria
L’iperossaluria primaria (primary hyperoxaluria, PH) è una famiglia di malattie epatiche genetiche gravi, estremamente rare, caratterizzate dalla sovrapproduzione di ossalato, una sostanza chimica naturale presente nell’organismo, che viene normalmente espulsa come rifiuto attraverso i reni. Per ulteriori informazioni, clicchi qui.
Informazioni su Dicerna Pharmaceuticals
Dicerna Pharmaceuticals, Inc. è un’azienda biofarmaceutica appartenente al gruppo Novo Nordisk impegnata a scoprire, sviluppare e commercializzare farmaci progettati per sfruttare l’interferenza dell’acido ribonucleico (RNAi) per silenziare selettivamente i geni che causano o contribuiscono alla malattia. Tra Dicerna e i nostri partner collaborativi sono attualmente in corso più di 20 programmi di indagine, preclinici o clinici, incentrati su malattie cardiometaboliche, virali, epatiche croniche e mediate dal complemento, nonché su malattie neurodegenerative e sul dolore.
Per maggiori informazioni sull’Informativa sulla Privacy di Dicerna, clicchi qui.
Informazioni sulla sicurezza
Il farmaco sperimentale è destinato al trattamento dei pazienti affetti da PH. I farmaci sperimentali sono farmaci che non sono stati ancora approvati dalle agenzie regolatorie competenti. La sicurezza e l’efficacia del farmaco sperimentale non sono ancora state stabilite. La sicurezza e l’efficacia del farmaco sperimentale sono oggetto di valutazione in studi attuali e futuri.
©2021 Dicerna Pharmaceuticals, Inc. / Lexington, MA



 English
English Italiano
Italiano Polski
Polski Español
Español Deutsch
Deutsch